1. Einleitung:
 |
Männliche G. insculpta im Biotop am River Denis |
Glyptemys insculpta gehört in den USA und Kanada zu den stark gefährdeten Arten und ist deshalb folgerichtig nach dem Washingtoner Artenschutzabkommen auf Anhang B geführt.
Bei einer Reise im September 2001 nach Nova Scotia, Kanada, zusammen mit ANDREAS GRÄF, DIETZENBACH, konnten wir Freiland- und Populationsuntersuchungen bei G. insculpta vornehmen. Eine entsprechende Arbeit dazu ist in Vorbereitung.
Seit 1989 beschäftige ich mich auch mit der Aufzucht von Glyptemys insculpta und möchte einige Erfahrungswerte weitergeben.
Außerdem soll an dieser Stelle über Haltung, Aufzucht und Nachzucht bis zur F2-Generation von Glyptemys insculpta in zehn aufeinanderfolgenden Jahren berichtet werden. Es sind bei 48 Eiablagen aus 421 Eiern 309 Jungtiere geschlüpft. Dabei ist zu bemerken, dass zwei Weibchen, die 1989 geschlüpft sind, 1998, also nach neun Jahren, erstmals nachgezüchtet haben.
 |
Wie
TRUTNAU (1983) beschrieb, unterscheiden sich auch meine Tiere in der
Weichteilzeichnung, die Variationsbreite liegt zwischen gelblich braun
bis orangerot. |
 |
||
Biotopaufnahme
am McLennan Brook,Cape Brenton Island, Nova Scotia, Kanada |
|
Biotopaufnahme
ma McLennan Brook,Cape Brenton Island, Nova Scotia, Kanada, mit
Blick auf eine Sandbank, die als Ablagestelle von G. insculpta genutzt wird |
2. Aufzucht der Jungtiere
 |
Seit 1989 beschäftige ich mich mit der Aufzucht von Glyptemys insculpta, welche ich aus der Zucht von Herrn LAMBERTZ erhalten habe. Ab 1992 habe ich auch Tiere aus meiner Zucht aufgezogen. Es hat sich gezeigt, dass weibliche Glyptemys insculpta circa nach 9 Jahren Geschlechtsreife erreichen. Männliche Tiere versuchen, bereits nach 4 bis 5 Jahren zu kopulieren. |  |
Sandbank
im River Denis. Zu sehen sind drei markierte Eiablageplätze
von G. insculpta |
Wahrscheinlich
von einem Waschbären geplündertes Gelege von G. insculpta auf einer Sandbank am River Denis |
Bei der Aufzucht frischgeschlüpfter
Tiere haben sich drei Varianten von Terrarien bewährt:
 |
Aufzuchtbecken
"a" |
a.) Ich biete den
Tieren in einem Aquaterrarium LBH 60 x 30 x 30 cm einen Land- und einen
Wasserteil. In einer Höhe von circa 8 cm ist ein Landteil LBH 15
x 30 x 5 cm eingeklebt, welches die Tiere über einen Korkübergang
erreichen können. Dadurch können die Babys auch unter dem Landteil
schwimmen, was sie gerne nutzen. Der Wasserteil wird über einen Eheim-Außenfilter
gefiltert. Das Wasser wird nicht extra beheizt. Ein Wärmestrahler
(40 W) hängt im Abstand von etwa 20 cm über dem Korkübergang,
der auch als Sonnenplatz genutzt wird. Hier muss allerdings darauf geachtet
werden, dass es nicht zu einer Überhitzung kommt. Alternativ kann
das Aquaterrarium auch mit einer handelsüblichen Aquariumbeleuchtung
beleuchtet werden.
Der Wasserstand beträgt etwa 5 cm und ist der Größe der
Nachzuchten angepasst. Im Wasserteil befinden sich Steine und Wurzeln,
um den kleinen G. insculpta das Erreichen der Wasseroberfläche
zu ermöglichen. Eine Efeuranke aus Plastik verschönert den optischen
Eindruck und wird von den Tieren als Versteck genutzt. Einige der Jungtiere
klettern in diesem Efeu allerdings auch hoch und sitzen versteckt 10-15
cm über der Wasseroberfläche.
Der Landteil ist mit einem feuchten Torf - Sand - Gemisch gefüllt,
in das sich die Jungtiere zeitweise vergraben.
b.) Bei der zweiten Variante wird auf einen festverklebten Landteil verzichtet. Es handelt sich hier um ein Fünfeck - Aquarium, welches circa LBH 60 x 50 x 40 cm groß ist. Die Einrichtung des Wasserteil entspricht der des vorher genannten Aqua-Terrariums. Als Landteil dient eine Felsplatte, die so auf kleineren Steinen aufgebracht ist, dass die Tiere auch hier darunter schwimmen können. Hier wird das Wasser über einen Eheim-Innenfilter gefiltert, der Wasserstand ist um wenige Zentimeter erhöht. Als Beleuchtung dient eine Leuchtstoffröhre (15W). Auf einen Wärmestrahler wird verzichtet, um das Wasser nicht unnötig zu erhitzen.
c.) Auch bei der dritten
Variante wird auf den festverklebten Landteil verzichtet. Es handelt sich
hier um ein Aquarium, welches LBH 80 x 30 x 40 cm groß ist. Die
Einrichtung entspricht wiederum der des Wasserteils der vorher genannten
Aqua-Terrarien. Eine eingeklemmte Korkplatte ersetzte hier den Landteil.
Das Wasser wird über einen Eheim-Innenfilter gefiltert. Als Beleuchtung
dient eine Leuchtstoffröhre (15 W), um das Wasser nicht unnötig
zu erhitzen.
Selbstverständlich sollten die Aquarien jeweils der Größe
der wachsenden Tiere angepasst werden.
Gefüttert werden
die Schlüpflinge mit Gelatinefutter (BECKER 1992), aufgetauten roten
Mückenlarven, kleinen Regenwürmern, Zophoba- Larven und Schildkrötenfertigpellets
(PENK, Rüsselsheim). Das Gelatinefutter und vor allem die Mückenlarven
fressen sie ab dem dritten Tag problemlos. Nach einem bis zwei Monaten
fressen sie auch süße Früchte, wie zum Beispiel Bananen,
Erdbeeren, geschabte Äpfel und Birnen. Nach circa einem Jahr werden
auch Gräser und Kräuter angenommen.
Einige Punkte sind bei der Aufzucht unbedingt zu beachten, um Verluste zu vermeiden:
- Die kleinen G. insculpta sind sehr fressgierig. Oft wird man dann dazu verleitet, die Tiere mehr als nötig zu füttern. Dies kann dazu führen, dass die Tiere extrem stark wachsen, was besonders im ersten Jahr zu Gesundheitsproblemen und Verlusten führen kann. Mir sind Fälle bekannt, wo Nachzuchten bereits vor dem Erreichen des ersten Lebensjahres über 150g gewogen haben. Diese Tiere sind aber verendet.
- In der Spätsommer- und Herbstzeit müssen plötzliche Temperaturschwankungen vermieden werden. Diese können einerseits durch den Wechsel vom Freigehege in den wärmeren Terrarienraum, andererseits beim Wasserwechsel entstehen. Hier ist peinlich genau darauf zu achten, dass die Temperatur des Wassers nicht deutlich über den alten Bedingungen liegt. Die Erwärmung kann schnell zu Verlusten führen. Besser sollte man den Tieren kälteres Wasser anbieten.
- Juvenile bis subadulte C. insculpta sind stressanfällig. Die Vergesellschaftung mit den adulten Tieren führt bei den kleinen Männchen unweigerlich zum Tod. Auch bei den jungen Weibchen ist die Vergesellschaftung nicht zu empfehlen, da diese sofort von den adulten Männern angepaart werden. Da dieses, wie in Kapitel 5.1 beschrieben, recht rabiat abläuft, überleben einige der subadulten Weibchen diese Paarungsversuche nicht. Die Vergesellschaftung größerer Weibchen ab etwa 650 g hat dagegen keine nennenswerten Probleme bereitet.
- Sollte bei der Gemeinschaftshaltung kleiner Tiere festgestellt werden, dass eines oder mehrere der Tiere in seiner Entwicklung zurückbleiben, müssen diese sofort separiert werden.
- Auch die Gemeinschaftshaltung subadulter Tiere ist nicht unproblematisch. Männliche Tiere ab circa 350 g Masse bedrängen die Weibchen ständig und versuchen zu kopulieren. Den so unter Stress gesetzten Weibchen muss die Möglichkeit gegeben werden zu flüchten. Deshalb halte ich meine subadulten Tiere ab dem vierten Jahr in einem "Aufzuchtfreigehege" von etwa 10 m2. In diesem Gehege befindet sich ein kleiner flacher Teich und zwei unbeheizte Schutzhütten. Zeigen sich bei einem Tier Stresssymptome, wird es sofort von den anderen getrennt.
- Da G. insculpta relativ ungeschickte Schwimmer sind, müssen der Wasserteil bzw. der Teich so gestaltet sein, dass sich die Tiere nicht in Hölzern oder Schwimmpflanzen verfangen oder unter den Steinaufbauten verkeilen können. Die Tiere geraten dadurch leicht in Panik und ertrinken.
- Die Filter müssen so abgesichert sein, dass die Jungtiere von diesen nicht angesaugt werden. Dies ist besonders beim Außenfilter nötig.
- Der wichtigste
Punkt ist allerdings die Überwinterung! Eine kalte Überwinterung
der Jungtiere ist im ersten Jahr unbedingt erforderlich, um Verluste
zu vermeiden (TRUTNAU 1983).
Folgende Bedingungen haben sich bei der Überwinterung von Jungtieren bewährt:
- im ersten Jahr 5 Wochen bei 10 - 14° C
- im zweiten und dritten Jahr 10 Wochen bei 10 - 14° C
- im vierten Jahr 8 Wochen bei 4 - 8° C (vergleichbar mit den Elterntieren, nur kürzer) und
- ab dem fünften Jahr 12 Wochen bei 4 - 6° C (wie die Elterntiere)
In den ersten drei
Jahren werden die Tiere in ihren Terrarien belassen. Das Abschalten der
Beleuchtung sowie das Absenken der Raumtemperatur auf circa 10 - 14 °
C genügt hier als Winterruhe. Allerdings sollten die Terrarien abgedunkelt
werden. Ab dem vierten Jahr werden die Tiere abgedunkelt in einem circa
4 - 8° C kalten Gewächshaus überwintert.
Die größeren vergesellschafteten Weibchen verbleiben im Freigehege.
Als groben Anhaltspunkt für ein normales Wachstum sollen die nachfolgenden Größenklassen dienen:
- Beim Schlupf 8,45 g - 12,1 g
- nach 1 Jahr 40 g - 80 g
- nach 2 Jahren 120 g - 200 g
- nach 3 Jahren 200 g - 370 g
- nach 6 Jahren
690 g - 870 g
Die optimale Haltung von G. insculpta (Abb. 21) ist eine Grundvoraussetzung zur erfolgreichen Zucht. Hierzu möchte ich meine Erfahrungen bezüglich der Fütterung und der Gestaltung des Freilandes bekannt geben. Besondere Beachtung sollten dabei folgende Punkte finden:
- Gute Konstitution der Elterntiere
- Überwinterung
- Großes Gehege, um Stress zu vermeiden
- Flacher Ausstieg aus den Teichen um Verluste der Weibchen bei der Paarung zu vermeiden
- Wärmezufuhr in der für die Eientwicklung relevanten Zeit April / Mai und
- Geeignete Eiablageplätze.
3.1 Unterbringung der Zuchtgruppe
 |
Freigehege
im Frühjahr, mit beheizter Schutzhütte. Die halbkreisförmigen
Legehügel sind zu erkennen |
Glyptemys insculptaist aufgrund ihres großen Bewegungsbedürfnisses sowie ihrer
Unverträglichkeit untereinander und dem aggressiven Paarungsverhalten
nur begrenzt für die Terrarienhaltung zu empfehlen.
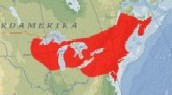
Allerdings eignet sich C. insculpta wegen ihrer geographischen Verbreitung
im Nordosten der USA und Südosten Kanadas (IVERSON 1992) wie kaum
eine andere Art für die Freilandhaltung in Deutschland. Das Klima
in ihrem Verbreitungsgebiet ist äußerst kontinental mit sehr
heißen Sommern und sehr kalten Wintern. Deshalb kann auch eine ganzjährige
Freilandhaltung empfohlen werden (siehe Tabelle 1).
Um dem großen
Bewegungsbedürfnis der Tiere Rechnung zu tragen, halte ich sie in
einem circa 60 qm großen Freigehege. (Abb. 12) In diesem Freigehege
leben inzwischen zwei Männchen und neun Weibchen. Die Tiere sind
vergesellschaftet mit einigen subadulten Emys orbicularis.
In dem Gehege befinden sich zwei gleich große Teiche, die beide
über je einen Eheim-Teichfilter gefiltert werden. Jeder dieser circa
10 qm großen Teiche hat einen ovalen Tiefbereich von etwa 90 cm
und einen langsam ansteigenden "Bachlauf" von circa 20 - 40
cm Tiefe. Die Teiche sind mit Wassersalat, Wasserlilien und Seerosen bepflanzt,
um den Nährstoffgehalt des Wassers zu reduzieren.
Da die männlichen Tiere untereinander recht aggressiv sind (NIETZKE
1969), sollte man ihnen die Möglichkeit geben, sich "aus dem
Weg" zu gehen. Das Gehege wurde zu diesem Zweck in der Mitte durch
einen 30 cm hohen Sichtschutz aus Brettern geteilt, in dem sich ein Durchschlupf
von circa 40 cm Breite befindet. Auch die Bepflanzung des Freigeheges
mit Krüppelkiefern, Azaleen, Rhododendron, Strauchrosen, Haselnussstrauch,
Bambus, sowie die Einrichtung des zweiten Teiches ermöglicht es den
männlichen Tieren, gesondert zu leben.
Im Gelände befindet sich eine Schutzhütte mit den Maßen
LBH 100 x 200 x 80 cm. Ihr Bodensubstrat besteht aus Rindenmulch. Mittels
eines Stromanschlusses in der Hütte besteht die Möglichkeit,
den Tieren in der für die Eientwicklung wichtigen Zeit (April/Mai)
eine Wärmequelle (eine Heizmatte (30 x 50 cm / 30 W) und einen 100
W Punktstrahler) zu bieten.
Beim Vergleich der Klimadaten Frankfurt / New York / Minneapolis ist besonders
auffällig, dass die mittleren minimalen Temperaturen sowie die Sonnenscheindauer
in New York und in Minneapolis in den Monaten April/Juni deutlich höher
liegen als in Frankfurt. In dieser Zeit entwickeln sich die Eier im Körper
der Schildkröten. Die mittlere maximale Temperatur unterscheidet
sich in diesen Monaten allerdings nur unwesentlich.
Nachdem ich in den Monaten von Ende März bis Ende Mai diese zusätzlichen
Wärmequellen und Lichtquellen installiert hatte (nach Empfehlung
von LAMBERTZ), stellten sich die Nachzuchterfolge ein.
| mittlere
Minimal- temperatur [°C] |
Frankfurt |
New
York |
Minneapolis |
| Januar | -3,0 |
-4,4 |
-14,4 |
| Februar | -2,5 |
-4,4 |
-13,3 |
| März | 0,0 |
-1,1 |
-5,6 |
| April | 3,8 |
5,6 |
2,2 |
| Mai | 7,9 |
11,7 |
8,9 |
| Juni | 11,1 |
15,6 |
14,4 |
| Juli | 13,0 |
18,9 |
17,2 |
| August | 12,6 |
18,9 |
16,1 |
| September | 9,6 |
15,6 |
11,1 |
| Oktober | 5,2 |
9,4 |
5,0 |
| November | 1,8 |
2,8 |
-3,3 |
| Dezember | -1,6 |
-1,7 |
-11,1 |
Sonnenscheindauer
[h] |
|||
| April | 188 |
213 |
231 |
| Mai | 230 |
237 |
272 |
| Juni | 211 |
268 |
302 |
Tab.1: Vergleich des
Klimas der mittleren minimalen Temperaturen, sowie der Sonnenscheindauer
am Haltungsort mit dem Herkunftsgebiet (nach MÜLLER, 1996)
Ich habe im Freigehege zwei Legehügel (KLOFT, mündl. Mittl.) angelegt, in denen alle weiblichen Tiere ihre Gelege vergruben. Diese Legehügel bestehen aus einem ansteigenden Halbkreis Sandsteinen mit einer nach Süden gerichteten Legefläche. Das Substrat besteht aus einer feuchten Mischung aus Erde, Sand und Torf. Der restliche Boden des Geheges ist mit Rasen zugewachsen.
Die Legehügel
werden aber auch außerhalb der Legezeit häufig von den Tieren
benutzt. Besonders an heißen Tagen, klettern meine Glyptemys insculpta oft auf die Hügel und bewerfen ihren Panzer mit dem jetzt ausgetrockneten
Substrat.
Anfänglich habe ich einige Überwinterungsarten ausprobiert, um schließlich die für die Tiere optimale Variante herauszufinden:
a.) Kühlschrank:
Im Winter 1989/90 habe ich die Tiere im Kühlschrank bei ca. +4°
C überwintert. Ich habe die Tiere in ein feuchtes Tuch gewickelt
und in einer offenen Plastikbox aufbewahrt. Durch den im Kühlschrank
befindlichen Ventilator trocknete dass feuchte Tuch ständig ab und
musste nachgefeuchtet werden. Dies führte zu einer Störung der
Tiere. Nach dem Winterschlaf hatte das Weibchen, ebenfalls durch den Luftzug
bedingt, eine starke Erkältung. Ich sah durch die Umluft so große
Nachteile, dass ich diese Methode in den Folgejahren nicht mehr angewendet
habe.
b.) Kontrollierte Bedingungen in einer Überwinterungskiste:
Ich habe die Tiere vom Winter 1991/92 an in einer mit Rindenmulch gefüllten Kiste mit den Maßen LHB 300 x 150 x 100 cm überwintert. In diese Kiste hatte ich zwei mit Wasser gefüllte Plastikwannen mit den Maßen LHB 100 x 50 x 20 cm eingebaut. Die Tiere verblieben darin bei 2 - 6 °C circa drei Monate bei Dunkelheit auf dem Dachboden. An wenigen sonnigen Tagen konnte die Temperatur hier auf circa 10° - 12° C ansteigen und die Tiere zeigten dann Aktivität.
c.) Im Freigehege:
Seit Winter 1995/96
belasse ich die Tiere ganzjährig in ihrem Freigehege. Diese Variante
stellte sich als die einfachste und zuverlässigste heraus. Der Temperaturwechsel
im Dezember aus dem relativ kalten Freiland in das doch etwas wärmere
Dachquartier und die Umkehrung im Frühjahr, war mit Stress für
die Tiere verbunden. Außerdem kam es vereinzelt nach dem Einsetzen
im Frühjahr ins Freigehege zu Erkältungserscheinungen. Diese
sind nach der ganzjährigen Freilandhaltung nicht mehr aufgetreten.
Die Tiere haben die Möglichkeit, sich in der frostsicheren Schutzhütte
bis ca. 40 cm einzugraben oder auf dem Teichgrund zu überwintern.
Die Schildkröten bevorzugen ausnahmslos den ovalen Tiefbereich einer
der beiden Teiche (GILHEN, 1984). Diese sind mit circa 90 cm so tief sein,
dass sie nicht durchfrieren.
Die Eheim-Teichfilter, die auch im Winter betrieben werden und so das
Wasser an der Oberfläche ständig in Bewegung halten, verhindern,
dass die beiden Teiche ganz zufrieren.
4. Fütterung
 |
Schildkrötenpudding
fressende weibliche G. insculpta |
Die Ernährung
stellt keinerlei Probleme da (SURFACE 1908, BABCOCK 1971, ERNST &
BARBOUR 1989, TRUTNAU 1983, GILHEN, 1984, ARTNER ET.AL. 1995, BECKER 1995,
HARDING 1997, VETTER & DAUBNER 2000). Die Tiere fressen alles, verschmähen
selbst Aas nicht (HARRISON, 1949, eig. Beob.).
Allerdings ist es auch hier wichtig, den Tieren besonders vor und nach
der Winterruhe und vor der Eiablage abwechslungsreiche und vitaminreiche
Kost anzubieten. Dies wird am besten durch den Schildkrötenpudding
erreicht, der in verschiedenen Varianten bereits beschrieben wurde und
auf dessen Herstellung hier nicht näher eingegangen werden soll (z.
B. BECKER, 1992).
5.1 Paarung:
Kopulationen und auch
Kopulationsversuche kann man im Freiland zwischen Frühjahr und Herbst
ständig beobachten. Das weibliche Tier wird vor der Paarung von dem
Männchen verfolgt, wobei Bisse in die Extremitäten und den Kopf
üblich sind. Das Männchen reitet nun auf das Weibchen auf und
versucht wiederum durch Bisse in den Kopf, das Weibchen zu zwingen, den
Schwanz nicht in den Panzer einzuziehen. Bei der Paarung verhalten sich
die männlichen Tiere so rabiat, dass man von einer regelrechten Vergewaltigung
sprechen kann. Da die Paarung sowohl an Land als auch im Wasser stattfindet,
ist es wichtig, den weiblichen Tieren durch schräge Ausstiege im
Wasserteil die Möglichkeit zu geben, während der Kopulation
im Teich an die Wasseroberfläche zu gelangen, um Luft zu holen. Sollte
diese Ausstiegsmöglichkeit nicht gegeben sein, kann es dazu kommen,
dass die Männchen in ihrer Paarungsstimmung die Weibchen ertränken.
Bei einen zu klein gewählten Behältnis, zum Beispiel bei der
Terrarienhaltung, kann es zu schwerwiegenden Bissverletzungen sowohl im
Schwanz- als auch im Halsbereich kommen.
5.2. Eiablage
 |
Die
Eiablage erfolgte in der Zeit vom 23. April bis 28. Juni, jeweils
bei drückend schwüles Wetter, dem häufig ein Gewitter
folgt. Diese Bedingungen bezeichne ich inzwischen als "Insculpta-Legewetter".
Eiablagen konnte ich am Mittag sowie bis in die frühen Abendstunden
beobachten. Eiablagen am Morgen, wie ERNST et. al. 1994 beschrieben
haben, kann ich bisher nicht bestätigen. Wie bei vielen anderen Schildkröten deutet sich eine Eiablage durch das unruhige Herumwandern des Weibchens an. Jetzt kann man deutlich in der Hinterbeingrube die Eier palpieren (BECKER 1996) und hat dadurch auch eine Legekontrolle. Das Torf/Sand/Erdegemisch im Legehügel wird jetzt mit 2 - 3 l warmem Wasser angefeuchtet. Die Weibchen heben die Legekuhle üblicherweise mit den Hinterbeinen aus. Vereinzelt habe ich aber auch beobachtet, dass die Weibchen bis zu einer gewissen Tiefe die Kuhle mit den Vorderbeinen graben und dann mit den Hinterbeinen vollenden. Nach der Ablage der Eier schließt das Weibchen die Legekuhle und glättet sie anschließend mit ihrem Plastron. Der gesamte Legevorgang kann bis zu vier Stunden dauern, aber auch bereits nach 60 Minuten beendet sein. |
 G. insculpta bei der Eiablage |
G.
insculpta nach der Eiablage beim Verschliessen des Nestes |
Jahr |
Weibchen
1 |
Weibchen
2 |
Weibchen
3 |
Weibchen
4 |
Weibchen
5 |
1991 |
09.06./4(0) |
03.06./4(0) |
|||
1992 |
19.05./4(4) |
19.05./11(7) |
|||
1993 |
18.05./5(3) |
28.05./6(4) |
28.05./6(5) |
||
1994 |
06.06./11(11) |
03.06./5(0) |
03.06./6(4) |
23.04./11(2) |
|
Zweitgelege
9(0) |
|||||
1995 |
03.05./7(0) |
23.05./7(6) |
|||
1996 |
24.05./7(0) |
24.05./8(1) |
31.05./9(7) |
01.05./7(5) |
|
1997 |
08.06./10(9) |
06.06./2(0) |
26.05./7(6) |
11.05./8(7) |
|
1998 |
26.05./11(11) |
05.06./3(0) |
12.05./9(7) |
07.05./9(9) |
|
1999 |
01.06./4(4) |
11.06./5(5) |
19.05./9(8) |
06.05./10(10) |
|
2000 |
15.05./12(10) |
04.06./8(8) |
12.05./4(4) |
08.05./11(10) |
|
2001 |
27.05./12(12) |
20.06./7(7) |
01.06./6(6) |
||
Weibchen
6 |
Weibchen
7 |
Weibchen
8 |
Weibchen
9 |
||
1998 |
07.06./15(14) |
07.06./10(10) |
20.05./13(0) |
||
1999 |
27.05./17(5) |
08.06./13(11) |
20.05./6(4) |
||
2000 |
01.06./15(13) |
01.06./8(8) |
|||
2001 |
07.06./17(17) |
14.06./16(15) |
28.06./17(3) |
Tab.2: Legedaten, Gelegegrößen und Anzahl Schlüpflinge (in Klammern)
An Tabelle 2 wird deutlich, dass keine einheitliche Aussage zur Legezeit,
zum Legerhythmus und zur Gelegegröße gemacht werden kann. Allerdings
ist hier bestätigt, dass Glyptemys insculpta auf keinen Fall
einen zweijährigen Legerhythmus hat. Zweitgelege sind entgegen den
Literaturangaben ebenfalls möglich, wenn auch überaus selten
(nur eines von 48 Gelegen).
Auf die Einarbeitung des Zweitgeleges von Weibchen 5 aus 1994 wurde allerdings
bei der Tabelle 2 verzichtet.
Es zeigt sich, dass die Änderungen der Überwinterung, sowie
die Anpassungen des Freigeheges zu einer konstanten Verbesserung bei den
Nachzuchten geführt hat.
In den einzelnen Jahren bestehen keine bestimmten Legezeiten. Allerdings kann man die Zeit der Eiablage für die Freilandhaltung in unseren Breiten etwa von Mitte Mai bis Mitte Juni annehmen (Tab. 3). Nach Angaben von JOHN GILHEN erfolgt die Eiablage auf Cape Breton Island, Kanada in der Zeit von Mitte Juni bis Anfang / Mitte Juli, also etwas zeitversetzt.
| 20. April bis 10. Mai | 6
Gelege |
| 11. Mai bis 20. Mai | 11
Gelege |
| 21. Mai bis 31. Mai | 9
Gelege |
| 01. Juni bis 10. Juni | 17
Gelege |
| 11. Juni bis 28. Juni | 4
Gelege |
Tabelle
3: Gelegezeiträume |
|
 |
selbstkonstruierter
Brutkasten oben rechts Gelege von G. insculpta |
Die 38 - 42 mm langen
und im Durchmesser 20 - 23 mm breiten, weichschaligen Eier grub ich nach
der Ablage (Abb. 15) vorsichtig aus und habe sie im selbstkonstruierten
Brutkasten in feuchtem Vermiculit gezeitigt.
Der Brutkasten ist wie folgte konstruiert (nach EIDENMÜLLER):
Eine Styroporkiste wird mit einer Heizmatte, die über ein Kontaktthermometer
geregelt wird, auf konstant 28° ±1° C geheizt. Die Eier
befinden sich in Plastikbehältern, die durch drehen des Deckels mit
Lüftungsöffnungen versehen werden können.
Die Masse der Eier
schwankt zwischen 10.95 g und 12.4 g (ermittelt an drei Gelegen 1996 mit
insgesamt 20 Eiern).
Die Anzahl der Eier pro Gelege schwankt zwischen 2 und 17 (vergleiche
HARDING 2000). Bei 48 Gelegen ist die durchschnittliche Gelegegröße
8,9. Es ist auffällig, dass die beiden Nachzuchtweibchen deutlich
höhere Gelegegrößen haben als die Wildfänge.
5.3 Schlupf der Jungtiere
 |
Etwa
eine Woche alte >G. insculpta (rechts)
im Vergleich mit einer eine Woche
alten Mauremys japonica Aufnahme B. Eidenmüller |
Bereits nach wenigen Stunden lässt sich mit ziemlicher Sicherheit feststellen, ob die Eier befruchtet sind. Die direkt nach der Ablage glasig, zartgelblich erscheinenden Eier bilden an der Oberseite einen weißen Punkt aus, der sich im Laufe der Inkubation über das gesamte Ei ausbreitet, so dass die Eier dann kalkig weiß aussehen. Unbefruchtete Eier bleiben in ihrer ursprünglichen Farbe und zeigen keinerlei Veränderung.
ERNST et. al. (1994)
berichten, dass es bei G. insculpta während der Inkubation
keine Temperaturabhängigkeit der Geschlechterentwicklung gibt und
geben als Freilandangaben eine Inkubationsdauer von 70 bis 80 Tagen an.
Aus 37 Gelegen mit 333 Eiern schlüpften nach einer Inkubation in
feuchtem Vermiculit bei 28° ±1° C nach 42 - 57 Tagen bei
mir insgesamt bis jetzt 303 Jungtiere. Dies entspricht einer Schlupfrate
von 90,1 %.
Insgesamt 11 Gelege mit 88 Eiern, aber nur 6 Jungtieren, wurden aus unterschiedlichsten
Gesichtspunkten, wie zum Beispiel Isolation, Eiablage beim Transport vom
Händler, Erkältung des Weibchens, Zweitgelege, usw. (BECKER,
1997) wurden nicht berücksichtigt.
Die Eier werden von den Schlüpflingen wie bei vielen anderen Arten
an den Polenden geöffnet. Beim Schlupfvorgang "platzen"
die Eier dann der Länge nach auf. Die Schlüpflinge verbringen
dann noch einige Stunden im geöffneten Ei.
Zur Entwicklung benötigen die Eier eine sehr hohe Substrat- und Luftfeuchtigkeit.
Beim Abtrocknen des Substrates fallen die Eier ein. Durch ein späteres
Anfeuchten nehmen die Eier zwar wieder ihre ursprüngliche Form an,
jedoch ist mit Verschlechterung der Schlupfrate zu rechnen. Ein Verhältnis
von 70 g Vermikulit zu 230 g Wasser hat sich bewährt.
Das Durchschnittsgewicht von 13 Jungtieren von 1996 betrug 9,91 g. Das
kleinste Tier wog 8,45 g, das Größte 10,26 g. Das Verhältnis
Jungtiergewicht / Eigewicht schwankt zwischen 0,82 g und 0,865 g. Die
leeren Eischalen wogen nach dem Schlupf zwischen 0,58 g und 0,69 g.
 |
24
und 12 Monate alte G. insculpta im Vergleich, gut sichtbar
die beginnende helle Plastronzeichnung der älteren Tiere Aufnahme B. Eidenmüller |
Die Schlüpflinge
sind einfarbig grau bis hellbraun gezeichnet, das Plastron ist einfarbig
dunkelbraun bis schwarz. Die Jungen haben einen im Verhältnis zum
Panzer sehr langen Schwanz. Nach circa einem Jahr verändert sich
die Zeichnung des Plastrons hin zu einer hellen Grundfarbe mit dunklen
Rändern. Erst später, etwa mit 2 bis 3 Jahren, entwickelt sich
die typische radiär verlaufende Linienfärbung des Carapax. Die
Weichteilzeichnung ist etwa nach 5-6 Jahren zu erkennen.
Die Unterscheidung der Geschlechter ist erst mit circa 3 bis 4 Jahren
und einem Gewicht von etwa 350 - 400 g möglich. Dann erst sieht man,
dass sich der Schwanzansatz des Männchens verdickt und die typisch
nach innen gewölbte Form des Plastrons ausgeprägt wird.
Die Waldbachschildkröten Glyptemys insculpta (LE CONTE, 1830) wurden bis Frühjahr 1995 in einem Freilandterrarium von Mitte Februar bis Anfang Dezember gehalten und zur Überwinterung in eine mit Rindenmulch gefüllte Kiste überführt. Seit Frühjahr 1995 werden die Tiere ganzjährig im Freiland belassen. 48 Eiablagen vom 23. April bis 28. Juni mit insgesamt 421 Eiern von allen neun Weibchen über zehn Jahre werden beschrieben. Die Jungtiere schlüpften nach 42 - 57 Tagen. Beschrieben wird die Aufzucht und Überwinterung von Jungtieren über einen Zeitraum von 10 Jahren.
Bei ACHIM FLAMME,
FRIEDBERG, HARALD MÖßNER, PFORZHEIM, VOLKER SCHROLLER, BÜDINGEN
UND RUDOLF WICKER, FRANKFURT möchte ich mich ganz besonders bedanken.
Durch ihre Bereitschaft, ihre Tiere in meine Gruppe zu integrieren, wurde
dieser zahlenmäßig große Erfolg mit ermöglicht.
Bei BERND EIDENMÜLLER, FRANKFURT möchte ich mich für die
Hilfe bei der Pflege und für die Tipps bei der Haltung und Einrichtung
der Gehege bedanken.
Bei JOHN GILHEN, HALIFAX und ANDREAS GRÄF, DIETZENBACH möchte
ich mich für die Informationen über die Freilandbedingungen
von Clemmys insculpta bedanken.
Nicht zuletzt Dank gebührt ANDREAS MÜLLER, AUL, der das Manuskript
rezensiert hat.
Schriften:
ARTNER, H., B. STEINER,
& N. STRAUS, (1995): Über die Haltung und Zucht von Clemmys
insculpta. - St. Pölten, Emys (Vereinszeitschrift der Schildkrötenfreunde
Österreich) 2(6): 5-9
BABCOCK, H.E. (1971): Turtles of the Northeastern United States. - New
York
BECKER, H. (1992): Beobachtungen bei der Haltung und Nachzucht von Sternotherus
carinatus (GRAY, 1856). - Bonn, Salamandra 28(1): 9-13
- (1995): Bemerkungen bei der Freilandhaltung und Nachzucht von Clemmys
insculpta (LECONTE, 1830). - Bonn, Salamandra 31(1): 41-48
- (1996): Bemerkungen bei der Haltung und Nachzucht von Cuora flavomarginata
flavomarginata (GRAY, 1863). - Bonn, Salamandra 32(2): 65-72
- (1997): Weitere Bemerkungen zur Freilandhaltung und Nachzucht von Clemmys
insculpta (LECONTE, 1830). - Journal der AG Schildkröten 6(3):
17-30
ERNST, C.H. & BARBOUR, R.W.(1989): Turtles of the world. - Washington:
(Smithsonian Institution Press), 313S.
ERNST, C.H., LOWICH, J.E. & BARBOUR, R.W. (1994): Turtles of the United
States and Canada. - Washington,D:C: (Smithsonian Institution Press),
578 S.
GILHEN, J. (1984): Amphibians and Reptiles of Nova Scotia. - Halifax,
The Nova Scotia Department of Government, 162 S.
HARDING J. .H (1997): Amphibians and Reptiles of the great Lakes Region.
- Michigan (The University of Michigan Press), 378 S.
HARRISON, H. H. (1949): Pennsylvania Reptiles & Amphibians. - Pennsylvania
Fish Commission (ohne Ortsangabe)
IVERSON, J. B. (1992): A revised checklist with distribution maps of the
turtles of the world. - Richmond, Indiana (Iverson Publishing), 363 S.
MÜLLER, M. J. (1996): Handbuch ausgewählter Klimastationen der
Erde - Ruwertal (Universität Trier, Forschungsstelle Bodenerosion
der Universität Mertesdorf), 400 S.
SURFACE, E.A. (1908): First Report on the economic features of turtles
of Pennsylvania. - Zool. Bull., Div. of Zool. Penna. Dept. Agric., Vol
6 ( 4 - 5), p. 105-195.
TRUTNAU, L. (1983): Clemmys insculpta (LE CONTE 1830), eine bemerkenswerte
Sumpfschildkröte aus dem nordöstlichen Nordamerika. - Herpetofauna,
Weinstadt 5 Heft 22: 14 - 22.
VETTER, H & M. DAUBNER (2000): Das Schildkrötenlexikon auf CD.
- Bergheim, L. Straackmannverlag KG